
我国网/我国开展门户网讯 近来,我国科学院近代物理研讨所科研人员及合作者在重离子治癌微观机理研讨方面获得重要开展,初次在生物分子团簇中观测到重离子辐照导致的分子间能量及质子转移级联机制。该机制被以为是重离子治癌生物学效应优异的重要原因。相关成果于3月11日作为亮点论文宣布在物理学尖端期刊《物理谈论X》(Physics Review X)上,并被美国物理学会Physics杂志在线报导。
重离子治癌是使用重离子束流杀死癌细胞的一种放射医治技能,是现在最先进的放射医治办法。自1946年科学家提出用重离子医治肿瘤以来,全球已有超越五万例患者接受了重离子医治。
我国科学院近代物理研讨所许慎跃研讨员介绍:“在相同的剂量下,重离子对癌细胞的杀伤才能比x射线倍。并且重离子放疗能直接引发肿瘤细胞DNA的双链断裂,生物学效应显着更高。但终究是什么微观机制在这其间起到了及其重要的效果,长期以来并不清晰。”
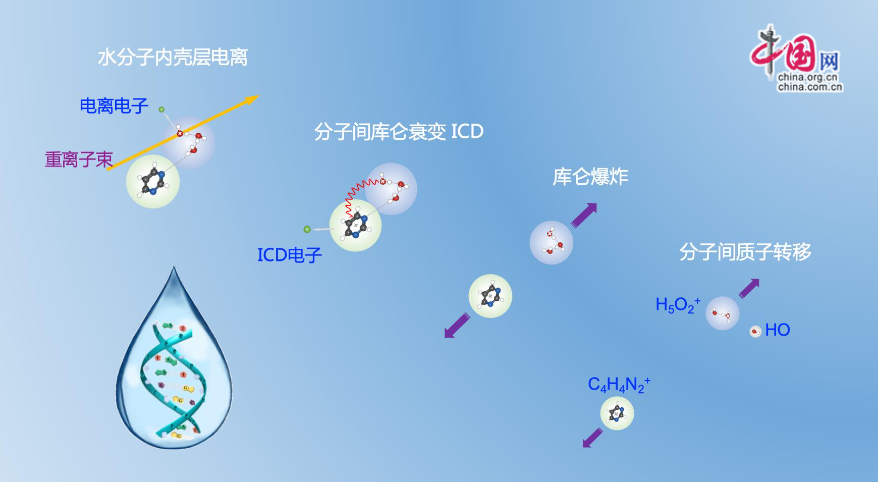
为了深化探求这一问题,科研人员开展了先进的混合团簇源技能,选取DNA中的一种根本结构单元——嘧啶分子作为模型。研讨团队把水分子和嘧啶分子合在一起,制备了尺度可控的水合嘧啶团簇来模仿机体安排环境。该试验在兰州重离子加速器冷却贮存环和320 kV高电荷态离子归纳研讨平成。
研讨团队初次观测到,当重离子辐照水分子时,会诱发它和生物分子间的分子间库仑衰变(ICD)进程。内壳层电离的水分子经过ICD将能量传递给嘧啶分子,导致嘧啶分子电离并开释一个低能电子。ICD进程还会促进诱发水分子之间的质子转移,发生也具有杀伤力的羟基自由基(HO)。

安装在兰州重离子加速器冷却贮存环的反响显微成像谱仪(供图:我国科学院近代物理研讨所)
一般以为,内壳层电离的水分子并不直接效果于DNA,而是经过本身解离的方法衰变。但此项研讨标明,机体安排中内壳层电离的水分子可以直接效果于DNA将其电离,一起还会在DNA周围发生有杀伤力的次级粒子。这一进程增大了DNA双链一起被损坏的可能性。此外,重离子辐照引起水分子内壳层电离的份额,显着高于电子、X射线和质子等其它射线。
“此次发现的微观机制,是重离子生物学效应高的重要原因。这项研讨可以在必定程度上协助咱们深化了解辐射损伤的分子机制,有助于在未来优化癌症医治战略、促进放射医治新技能的开展。”我国科学院近代物理研讨所马新文研讨员表明。
该作业由我国科学院近代物理研讨所主导,联合俄罗斯伊尔库茨克国立大学、德国海德堡大学、我国科学技能大学、西安交通大学和兰州大学等单位共同完成。
网站地图sitemap备案号:豫ICP备17022679号-2 技术支持:体育bob
 豫公网安备 41072102000363号
豫公网安备 41072102000363号